
1、有机物的水解---“基团”交换
模式:X-Y+H-OH → HY+XOH
特点:缓慢、微弱、可逆、有副反应
2、含弱离子的盐类水解----“离子”交换
模式:
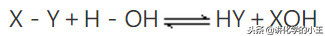
特点:吸热、微弱、可逆
3、非盐型无机物水解----一分为二,异性相吸,等量交换
注:化合物分成两部分,分析微粒带电情况,正正等电量交换,负负等电量交换,可能交换后出现归中、歧化、分解、化合等连续的变化。
模式:X-Y+ H-OH = HY+XOH
特点:放热、彻底、完全(完全双水解反应与此相似)

Mg3N2+8H2O=3Mg(OH)2+2NH3·H2O,
Al4C3 +12H2O=4Al(OH)3+3CH4↑
AlN+3H2O+OH-=[Al(OH)4]-+NH3↑
Mg2Si+4H2O=2Mg(OH)2+SiH4↑(CN)2+H2O=HCN+HNO
Ca3N2+6H2O=3Ca(OH)2+2NH3↑;(SCN)2+H2O=HSCN+HSCNO
CaC2+2H2O=Ca(OH)2+C2H2↑;AlP+3H2O=Al(OH)3+PH3↑
PCl5+4H2O=H3PO4+5HClSOCl2+H2O=SO2↑+2HCl↑
Si3N4+9H2O=3H2SiO3+4NH3;ICl3+3H2O=HIO3+5HCl
BCl3+3H2O=H3BO3↓+3HClPCl3+3H2O=H3PO3+3HCl
BrCl3+2H2O=3HCl+HBrO2BrCl+H2O=HCl+HBrO
2CH3MgCl(液体)+2H2O=Mg(OH)2↓+MgCl2+2CH4↑。
上面的反应特点为:放热、彻底、完全(完全双水解反应与此相似)
1、先水解,再分解:比如含-O-O-和-S-S-键时的水解反应2S2Cl2+2H2O=4HCl+SO2↑+3S↓;
2CaO2+2H2O=2Ca(OH)2+O2↑;先水解,再分解,其中CaO2和S2Cl2既作氧化剂又作还原剂
2、先水解,再歧化
2CuH+2HCl=CuCl2+2H2↑+Cu(先交换,有归中,再歧化)
3、先水解能归中
CaH2+H2SO4=CaSO4+2H2↑;CaH2+2H2O=Ca(OH)2+H2↑;NH4H+H2O=NH3·H2O +H2↑
(离子型氢化物如NaH、LiH、CaH2、NH4H中的氢为-1价,均可先交换,能归中反应生成H2)
通过观察后的结论:无论多么复杂,反应的模式为:先交换,再其它。
Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3;先交换再化合
SiHCl3+3H2O=H2SiO3↓+3HCl+H2↑;既交换,又归中。
Al4C3+12HCl=4AlCl3+3CH4↑;先交换,再中和
如果你认为太复杂的方程式,不需要掌握。
NCl3+3H2O=NH3↑+3HClO(N元素显-3价,Cl元素显+1价)
注意:NCl3的水解不生成两种酸!
H2O+OF2=O2+2HF,交换能归中;
3BrF3+5H2O==9HF+Br2+HBrO3+O2
 TCL天花机售后服务号码—全国统一客服热线实时反馈-今-日-更-新
TCL天花机售后服务号码—全国统一客服热线实时反馈-今-日-更-新
 韩国现代热水器全国各市售后服务点热线号码实时反馈全+境+到+达
韩国现代热水器全国各市售后服务点热线号码实时反馈全+境+到+达
 久赞智能锁全国各市售后服务热线号码实时反馈-今-日-更-新
久赞智能锁全国各市售后服务热线号码实时反馈-今-日-更-新
 春天指纹锁售后服务24小时服务热线-全国400服务号码实时反馈-今-日-汇-总
春天指纹锁售后服务24小时服务热线-全国400服务号码实时反馈-今-日-汇-总
 亿田煤气灶售后服务号码24小时实时反馈全+境+到+达
亿田煤气灶售后服务号码24小时实时反馈全+境+到+达
 普罗巴克智能锁全国各市售后服务热线号码实时反馈全+境+到+达
普罗巴克智能锁全国各市售后服务热线号码实时反馈全+境+到+达
 斯密锅炉客服号码售后号码大全及维修网点查询实时反馈-今-日-更-新
斯密锅炉客服号码售后号码大全及维修网点查询实时反馈-今-日-更-新
 赫斯曼锅炉全国统一售后24小时受理客服中心实时反馈全+境+到+达
赫斯曼锅炉全国统一售后24小时受理客服中心实时反馈全+境+到+达
 美浩集成灶400全国各售后服务热线号码实时反馈-今-日-更-新
美浩集成灶400全国各售后服务热线号码实时反馈-今-日-更-新
 金欧保险柜/全国各市服务热线号码实时反馈-今-日-更-新
金欧保险柜/全国各市服务热线号码实时反馈-今-日-更-新